Kankercellen houden van suiker (glucose) en dat heeft te maken met het Warburg-effect. Wat is dit voor effect en wat betekent het voor de klinische praktijk?
Kankercellen houden van suiker (glucose) en dat heeft te maken met het Warburg-effect. Wat is dit voor effect en wat betekent het voor de klinische praktijk?
Onze cellen gebruiken ‘adenosinetrifosfaat’, ATP, als energiebron. De verwerking van brandstof naar ATP gebeurt grotendeels in de mitochondriën die bekend staan als de energiefabriekjes in onze cellen. ATP ontstaat tijdens de verbranding van glucose (uit koolhydraten), vetzuren (vetten) en aminozuren (eiwitten). Het maken van ATP gebeurt in drie stappen, via: glycolyse, citroenzuurcyclus en oxidatieve fosforylering. De laatste twee vinden plaats in de mitochondriën. De glycolyse levert 6 ATP, terwijl uit de citroenzuurcyclus maar liefst 30 ATP komt. Theoretisch staat 1 glucose dus voor 36 ATP.
Mitochondriën zijn dus verreweg de belangrijkste energieleveranciers. ATP-productie in mitochondriën vergt zuurstof en is 100 keer trager dan ATP productie via glycolyse (1-4).
Wat de Nobelprijswinnaar Otto Heinrich Warburg (1883-1970) ontdekte, is dat kankercellen het grootste deel (4) van hun energie halen uit de glycolyse. Dat doen ze ook als er genoeg zuurstof aanwezig is. 6 ATP in plaats van 36: dat komt niet erg efficiënt over. Bovendien raakt in hun glycolyse ook nog 4 van de 6 ATP verloren, omdat ze de glucose als melkzuur uitscheiden. In hun citroenzuurcyclus verbruiken tumorcellen het aminozuur glutamine, wat ook bijdraagt aan de vorming van melkzuur (4). Daarbij ontstaat een ‘zure’ tumoromgeving die selectieve groei, kwaadaardige progressie en resistentie tegen de conventionele therapie (1,3,4) bevordert.
Zijn kankercellen dieven van hun eigen portemonnee?
Samengevat maken tumorcellen dus nagenoeg geen gebruik van de mitochondriën voor het maken van ATP en scheiden ze het super-zure en energierijke melkzuur uit. Het lijkt erop dat kankercellen dieven zijn van hun eigen portemonnee. Is dat ook zo?
Warburg’s gedachte was dat de mitochondriën van kankercellen slecht functioneren. Logisch, maar dat blijkt nagenoeg nooit het geval (2,4). Inmiddels is bekend dat het ‘Warburgeffect’ optreedt in alle cellen die snel delen. Bijvoorbeeld in immuuncellen na stimulatie bij een infectie, bij wondgenezing, de aanleg van nieuwe bloedvaten en in ook in embryo’s. Eigenlijk vertonen alle primitieve cellen die dicht tegen ‘stamcellen’ aanzitten het Warburgeffect; het is dus geen tumorkarakteristiek maar een eigenschap van snelle deling (2,4). En omdat niet alle kankercellen snel delen, treedt het Warburgeffect ook niet in alle tumoren op, maar naar schatting bij 70 tot 80 procent.
De reden dat snel-delende cellen het Warburgeffect vertonen is dat de glycolyse en citroenzuurcyclus niet alleen dienst doen voor het maken van ATP. Deze processen zijn ook nodig voor het maken van bouwstenen voor nieuwe cellen (1-5).
In de klinische praktijk wordt het Warburgeffect gebruikt om tumorcellen met beeldende technieken op te sporen (3). Door hun voorkeur voor snoepgoed (glucose) verraden ze zich. Onderzocht wordt of het Warburgeffect kan worden gebruikt om tumorcellen te doden. Voorbeelden zijn glucose-beperkte voeding, zoals een ketogeen- (6) of fasting-mimicking dieet (7). Of door de remming van het glucose transportsysteem GLUT1 en enzymen in de glycolyse (3,8,9) en het glutamine metabolisme (9) met synthetische en natuurlijke stoffen (waaronder flavonoïden, zoals resveratrol; 3,8).
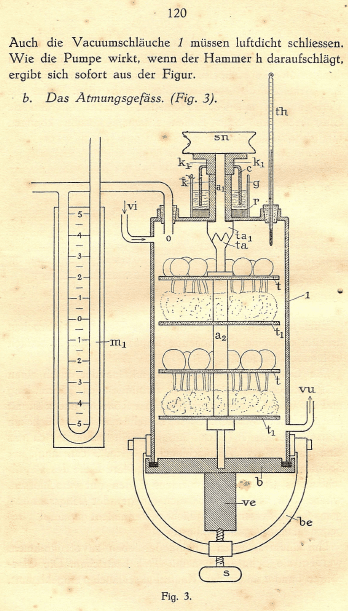
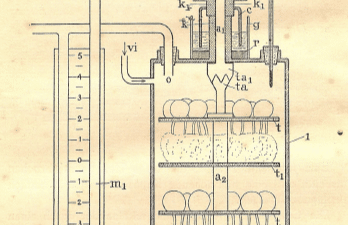
In het apparaat zie je ontkiemende erwten. ‘Mijn opa heeft gemeten hoeveel zuurstof werd geconsumeerd en hoeveel CO2 werd geproduceerd tijdens het ontkiemen.’ Bekijk een deel uit het oorspronkelijke proefschrift, het figuur staat op pagina 120.
1. Liberti MV, Locasale JW. The Warburg Effect: How Does it Benefit Cancer Cells? Trends Biochem Sci. 2016 Mar;41(3):211-218. doi: 10.1016/j.tibs.2015.12.001. Epub 2016 Jan 5. Erratum in: Trends Biochem Sci. 2016 Mar;41(3):287. Erratum in: Trends Biochem Sci. 2016 Mar;41(3):287. PMID: 26778478; PMCID: PMC4783224.
https://pubmed.ncbi.nlm.nih.gov/26778478/
2. Abdel-Haleem AM, Lewis NE, Jamshidi N, Mineta K, Gao X, Gojobori T. The Emerging Facets of Non-Cancerous Warburg Effect. Front Endocrinol (Lausanne). 2017 Oct 23;8:279. doi: 10.3389/fendo.2017.00279. PMID: 29109698; PMCID: PMC5660072.
https://pubmed.ncbi.nlm.nih.gov/29109698/
3. Samec M, Liskova A, Koklesova L, Samuel SM, Zhai K, Buhrmann C, Varghese E, Abotaleb M, Qaradakhi T, Zulli A, Kello M, Mojzis J, Zubor P, Kwon TK, Shakibaei M, Büsselberg D, Sarria GR, Golubnitschaja O, Kubatka P. Flavonoids against the Warburg phenotype-concepts of predictive, preventive and personalised medicine to cut the Gordian knot of cancer cell metabolism. EPMA J. 2020 Jul 30;11(3):377-398. doi: 10.1007/s13167-020-00217-y. PMID: 32843908; PMCID: PMC7429635.
https://pubmed.ncbi.nlm.nih.gov/32843908/
4. Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
https://pubmed.ncbi.nlm.nih.gov/33347611/
5. Shah MA, Rogoff HA. Implications of reactive oxygen species on cancer formation and its treatment. Semin Oncol. 2021 Jun;48(3):238-245. doi: 10.1053/j.seminoncol.2021.05.002. Epub 2021 Aug 4. PMID: 34548190.
https://pubmed.ncbi.nlm.nih.gov/34548190/
6. Kornberg MD. The immunologic Warburg effect: Evidence and therapeutic opportunities in autoimmunity. Wiley Interdiscip Rev Syst Biol Med. 2020 Sep;12(5):e1486. doi: 10.1002/wsbm.1486. Epub 2020 Feb 27. PMID: 32105390; PMCID: PMC7507184.
https://pubmed.ncbi.nlm.nih.gov/32105390/
7. de Groot S, Lugtenberg RT, Cohen D, Welters MJP, Ehsan I, Vreeswijk MPG, Smit VTHBM, de Graaf H, Heijns JB, Portielje JEA, van de Wouw AJ, Imholz ALT, Kessels LW, Vrijaldenhoven S, Baars A, Kranenbarg EM, Carpentier MD, Putter H, van der Hoeven JJM, Nortier JWR, Longo VD, Pijl H, Kroep JR; Dutch Breast Cancer Research Group (BOOG). Fasting mimicking diet as an adjunct to neoadjuvant chemotherapy for breast cancer in the multicentre randomized phase 2 DIRECT trial. Nat Commun. 2020 Jun 23;11(1):3083. doi: 10.1038/s41467-020-16138-3. PMID: 32576828; PMCID: PMC7311547.
https://pubmed.ncbi.nlm.nih.gov/32576828/
8. Meng Y, Xu X, Luan H, Li L, Dai W, Li Z, Bian J. The progress and development of GLUT1 inhibitors targeting cancer energy metabolism. Future Med Chem. 2019 Sep;11(17):2333-2352. doi: 10.4155/fmc-2019-0052. PMID: 31581916.
https://pubmed.ncbi.nlm.nih.gov/31581916/
9. Stine ZE, Schug ZT, Salvino JM, Dang CV. Targeting cancer metabolism in the era of precision oncology. Nat Rev Drug Discov. 2021 Dec 3:1–22. doi: 10.1038/s41573-021-00339-6. Epub ahead of print. PMID: 34862480; PMCID: PMC8641543.
MMV maakt wekelijks een selectie uit het nieuws over voeding en leefstijl in relatie tot kanker en andere medische condities.
Inschrijven nieuwsbrief








