Alzheimer ontstaat door zich ophopende eiwitten die de communicatie tussen hersencellen bemoeilijken. Aldus de heersende opvatting. Inmiddels lijkt deze theorie overtuigend achterhaald. Alzheimer wordt veroorzaakt door insulineresistentie. Maak kennis met diabetes mellitus type 3.
Alzheimer ontstaat door zich ophopende eiwitten die de communicatie tussen hersencellen bemoeilijken. Aldus de heersende opvatting. Inmiddels lijkt deze theorie overtuigend achterhaald. Alzheimer wordt veroorzaakt door insulineresistentie. Maak kennis met diabetes mellitus type 3.
In Nederland krijgen vijf mensen per uur de diagnose dementie. Bij 70 procent gaat het om Alzheimer, een ziekte die zich kenmerkt door het neerslaan van eiwitten (’amyloïd’) tussen hersencellen en eiwitkluwen (‘tangles’) in hersencellen (1). Waarom dit gebeurt, is onduidelijk maar het is waarschijnlijk niet de oorzaak maar een gevolg. Zulke eiwitafzettingen worden ook aangetroffen in hersenen van ouderen zonder Alzheimer. Sommigen beschouwen ze als een beschermingsmechanisme tegen oxidatieve stress (2).
De meeste Alzheimer-onderzoekers denken dat de eiwitophopingen leiden tot de dood van hersencellen en cognitieve achteruitgang. De celdood verklaart het lokale energietekort. De Canadese professor Stephen Cunnane draait het om: hij ziet het primaire probleem als een energietekort dat leidt tot celdood, cognitieve achteruitgang en Alzheimer. Hij wijst insulineresistentie aan als verantwoordelijke: een glucosetekort veroorzaakt een energietekort (3,4). Een ongezonde leefstijl is de belangrijkste oorzaak van insulineresistentie (5); een conditie die kan leiden tot diabetes mellitus type 2.
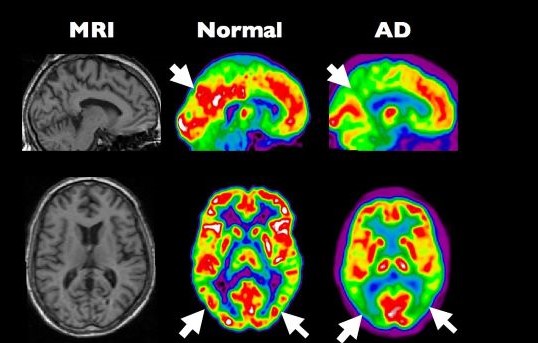
Onze hersenen gebruiken bij voorkeur glucose als brandstof, maar ze functioneren ook prima op ketonlichamen (3-7). Deze komen vrij als het lichaam tijdens vasten overschakelt op vetverbranding. Na een maaltijd gebruiken de hersenen vooral glucose, maar na weken vasten kan het aandeel ketonlichamen oplopen tot meer dan 60 procent (8,9). Een dagje zonder eten zet niet veel zoden aan de dijk (10). Cunnane constateerde dat de opname van glucose in de hersenen afneemt met het ouder worden. Op 60-jarige leeftijd bedraagt het energietekort 8 procent, bij milde cognitieve achteruitgang 12 procent en bij Alzheimer 20 tot 40 procent. Het energietekort treft vooral de hersenendelen die bij Alzheimer zijn aangedaan. Die delen hebben echter geen probleem met de opname van ketonlichamen.
Dus onderzocht Cunnane wat er gebeurt met deze hersensdelen bij suppletie met ketonlichamen. (4,11-13). In een zes maanden durende placebo-gecontroleerde studie kregen 39 personen van 72 jaar met milde cognitieve achteruitgang per dag 30 gram ‘middellange keten triglyceriden’ (MCT) (12,13). MCT bevatten vetzuren die worden omgezet in ketonlichamen zonder te vasten (14,15). 44 mensen van gelijke leeftijd met dezelfde aandoening vormden de controlegroep (12,13). Het verschil? In de MCT-groep verdubbelde de opname van ketonlichamen in de hersenen. Dat ging gelukkig niet ten koste van de glucose-opname. Voor de hersencellen dus pure energiewinst! Het energietekort daalde van 12 naar 9 procent. Ook was er ten opzichte van de placebogroep een lichte verbetering van de cognitie. Mogelijk zou het energietekort met een dosis van 45 gram MCT per dag nog verder kunnen dalen naar 6 procent. Maar de onderzoekers verwachten dat pure ketonlichamen efficiënter zijn en richten daar hun vervolgonderzoek op. Combinatie met een koolhydraatbeperkt dieet is ook een mogelijkheid (12,13). In eerdere studies veroorzaakte een ketogeen dieet (16,17) een daling van de eerdergenoemde eiwitten die Alzheimer kenmerken (18). Dat suggereert dat ze een gevolg zijn van Alzheimer en niet een oorzaak. De relatie tussen insulineresistentie en neurodegeneratie wordt steeds meer onderkend (5,8,19-21). Oorzakelijkheid lijkt voldoende bewezen en diabetes type 3 een passende naam. Nu beginnen met gezond(er) leven is zinvoller dan wachten op wetenschappelijke consensus.
Beeld: “PET scan of an healthy brain compared to a brain at an early stage of Alzheimer’s disease.” by Institut Douglas is licensed under CC BY-NC-ND 2.0
1. Alzheimer Nederland. Factsheet cijfers en feiten over dementie. Sccessed 13-04-2021.
https://www.alzheimer-nederland.nl/factsheet-cijfers-en-feiten-over-dementie
2. Makin S. The amyloid hypothesis on trial. Nature. 2018;559(7715):S4–S7. doi:10.1038/d41586-018-05719-4
https://www.nature.com/articles/d41586-018-05719-4
3. Cunnane S, Nugent S, Roy M, Courchesne-Loyer A, Croteau E, Tremblay S, Castellano A, Pifferi F, Bocti C, Paquet N, Begdouri H, Bentourkia M, Turcotte E, Allard M, Barberger-Gateau P, Fulop T, Rapoport SI. Brain fuel metabolism, aging, and Alzheimer’s disease. Nutrition. 2011 Jan;27(1):3-20. doi: 10.1016/j.nut.2010.07.021. Epub 2010 Oct 29. PMID: 21035308; PMCID: PMC3478067.
https://pubmed.ncbi.nlm.nih.gov/21035308/
4. Cunnane SC, Trushina E, Morland C, Prigione A, Casadesus G, Andrews ZB, Beal MF, Bergersen LH, Brinton RD, de la Monte S, Eckert A, Harvey J, Jeggo R, Jhamandas JH, Kann O, la Cour CM, Martin WF, Mithieux G, Moreira PI, Murphy MP, Nave KA, Nuriel T, Oliet SHR, Saudou F, Mattson MP, Swerdlow RH, Millan MJ. Brain energy rescue: an emerging therapeutic concept for neurodegenerative disorders of ageing. Nat Rev Drug Discov. 2020 Sep;19(9):609-633. doi: 10.1038/s41573-020-0072-x. Epub 2020 Jul 24. PMID: 32709961; PMCID: PMC7948516.
https://pubmed.ncbi.nlm.nih.gov/32709961/
5. Komleva Y, Chernykh A, Lopatina O, Gorina Y, Lokteva I, Salmina A, Gollasch M. Inflamm-Aging and Brain Insulin Resistance: New Insights and Role of Life-style Strategies on Cognitive and Social Determinants in Aging and Neurodegeneration. Front Neurosci. 2021 Jan 14;14:618395. doi: 10.3389/fnins.2020.618395. PMID: 33519369; PMCID: PMC7841337.
https://pubmed.ncbi.nlm.nih.gov/33519369/
6. Cunnane SC, Crawford MA. Survival of the fattest: fat babies were the key to evolution of the large human brain. Comp Biochem Physiol A Mol Integr Physiol. 2003 Sep;136(1):17-26. doi: 10.1016/s1095-6433(03)00048-5. PMID: 14527626.
https://pubmed.ncbi.nlm.nih.gov/14527626/
7. Cunnane SC, Crawford MA. Energetic and nutritional constraints on infant brain development: implications for brain expansion during human evolution. J Hum Evol. 2014 Dec;77:88-98. doi: 10.1016/j.jhevol.2014.05.001. Epub 2014 Jun 11. PMID: 24928072.
https://pubmed.ncbi.nlm.nih.gov/24928072/
8. Neth BJ, Craft S. Insulin Resistance and Alzheimer’s Disease: Bioenergetic Linkages. Front Aging Neurosci. 2017 Oct 31;9:345. doi: 10.3389/fnagi.2017.00345. PMID: 29163128; PMCID: PMC5671587.
https://pubmed.ncbi.nlm.nih.gov/29163128/
9. Cahill GF Jr. Fuel metabolism in starvation. Annu Rev Nutr. 2006;26:1-22. doi: 10.1146/annurev.nutr.26.061505.111258. PMID: 16848698.
https://pubmed.ncbi.nlm.nih.gov/16848698/
10. Evans M, Cogan KE, Egan B. Metabolism of ketone bodies during exercise and training: physiological basis for exogenous supplementation. J Physiol. 2017 May 1;595(9):2857-2871. doi: 10.1113/JP273185. Epub 2016 Dec 7. PMID: 27861911; PMCID: PMC5407977.
https://pubmed.ncbi.nlm.nih.gov/27861911/
11. Cunnane SC, Courchesne-Loyer A, St-Pierre V, Vandenberghe C, Pierotti T, Fortier M, Croteau E, Castellano CA. Can ketones compensate for deteriorating brain glucose uptake during aging? Implications for the risk and treatment of Alzheimer’s disease. Ann N Y Acad Sci. 2016 Mar;1367(1):12-20. doi: 10.1111/nyas.12999. Epub 2016 Jan 14. PMID: 26766547.
https://pubmed.ncbi.nlm.nih.gov/26766547/
12. Fortier M, Castellano CA, St-Pierre V, Myette-Côté É, Langlois F, Roy M, Morin MC, Bocti C, Fulop T, Godin JP, Delannoy C, Cuenoud B, Cunnane SC. A ketogenic drink improves cognition in mild cognitive impairment: Results of a 6-month RCT. Alzheimers Dement. 2021 Mar;17(3):543-552. doi: 10.1002/alz.12206. Epub 2020 Oct 26. PMID: 33103819.
https://pubmed.ncbi.nlm.nih.gov/33103819/
13. Cunnane SC. “MCT, Ketones and Brain Energy Rescue during Aging”. ISSFAL Lipids Online Launch January 20, 2021. Last viewed 10 April 2021.
14. Vandenberghe C, St-Pierre V, Pierotti T, Fortier M, Castellano CA, Cunnane SC. Tricaprylin Alone Increases Plasma Ketone Response More Than Coconut Oil or Other Medium-Chain Triglycerides: An Acute Crossover Study in Healthy Adults. Curr Dev Nutr. 2017 Mar 22;1(4):e000257. doi: 10.3945/cdn.116.000257. PMID: 29955698; PMCID: PMC5998344.
https://pubmed.ncbi.nlm.nih.gov/29955698/
15. St-Pierre V, Vandenberghe C, Lowry CM, Fortier M, Castellano CA, Wagner R, Cunnane SC. Plasma Ketone and Medium Chain Fatty Acid Response in Humans Consuming Different Medium Chain Triglycerides During a Metabolic Study Day. Front Nutr. 2019 Apr 16;6:46. doi: 10.3389/fnut.2019.00046. PMID: 31058159; PMCID: PMC6481320.
https://pubmed.ncbi.nlm.nih.gov/31058159/
16. Courchesne-Loyer A, Croteau E, Castellano CA, St-Pierre V, Hennebelle M, Cunnane SC. Inverse relationship between brain glucose and ketone metabolism in adults during short-term moderate dietary ketosis: A dual tracer quantitative positron emission tomography study. J Cereb Blood Flow Metab. 2017
https://pubmed.ncbi.nlm.nih.gov/27629100/
17. Jennings A, Cunnane SC, Minihane AM. Can nutrition support healthy cognitive ageing and reduce dementia risk? BMJ 2020;369:m2269.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7318880/
18. Neth BJ, Mintz A, Whitlow C, Jung Y, Solingapuram Sai K, Register TC, Kellar D, Lockhart SN, Hoscheidt S, Maldjian J, Heslegrave AJ, Blennow K, Cunnane SC, Castellano CA, Zetterberg H, Craft S. Modified ketogenic diet is associated with improved cerebrospinal fluid biomarker profile, cerebral perfusion, and cerebral ketone body uptake in older adults at risk for Alzheimer’s disease: a pilot study. Neurobiol Aging. 2020 Feb;86:54-63. doi: 10.1016/j.neurobiolaging.2019.09.015. Epub 2019 Sep 26. PMID: 31757576; PMCID: PMC7266642.
https://pubmed.ncbi.nlm.nih.gov/31757576/
19. Berlanga-Acosta J, Guillén-Nieto G, Rodríguez-Rodríguez N, Bringas-Vega ML, García-Del-Barco-Herrera D, Berlanga-Saez JO, García-Ojalvo A, Valdés-Sosa MJ, Valdés-Sosa PA. Insulin Resistance at the Crossroad of Alzheimer Disease Pathology: A Review. Front Endocrinol (Lausanne). 2020 Nov 5;11:560375. doi: 10.3389/fendo.2020.560375. PMID: 33224105; PMCID: PMC7674493.
https://pubmed.ncbi.nlm.nih.gov/33224105/
20. Schell M, Wardelmann K, Kleinridders A. Untangling the effect of insulin action on brain mitochondria and metabolism. J Neuroendocrinol. 2021 Jan 28:e12932. doi: 10.1111/jne.12932. Epub ahead of print. PMID: 33506556.
https://pubmed.ncbi.nlm.nih.gov/33506556/
21. Femminella GD, Livingston NR, Raza S, van der Doef T, Frangou E, Love S, Busza G, Calsolaro V, Carver S, Holmes C, Ritchie CW, Lawrence RM, McFarlane B, Tadros G, Ridha BH, Bannister C, Walker Z, Archer H, Coulthard E, Underwood B, Prasanna A, Koranteng P, Karim S, Junaid K, McGuinness B, Passmore AP, Nilforooshan R, Macharouthu A, Donaldson A, Thacker S, Russell G, Malik N, Mate V, Knight L, Kshemendran S, Tan T, Holscher C, Harrison J, Brooks DJ, Ballard C, Edison P. Does insulin resistance influence neurodegeneration in non-diabetic Alzheimer’s subjects? Alzheimers Res Ther. 2021 Feb 17;13(1):47. doi: 10.1186/s13195-021-00784-w. PMID: 33597002; PMCID: PMC7890851.
MMV maakt wekelijks een selectie uit het nieuws over voeding en leefstijl in relatie tot kanker en andere medische condities.
Inschrijven nieuwsbrief








