Een immuunreactie dient niet alleen gestart, maar ook afgeremd en actief gestopt te worden. Bij veel slachtoffers van het coronavirus ontbreekt balans in de immuunreactie.
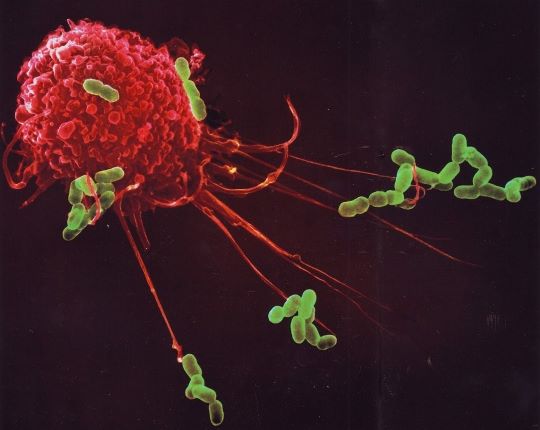
Een immuunreactie dient niet alleen gestart, maar ook afgeremd en actief gestopt te worden. Bij veel slachtoffers van het coronavirus ontbreekt balans in de immuunreactie.
Virale luchtweginfecties veroorzaken de lokale productie van ROS (Reactive Oxygen Species). Dat komt voor bij influenza-virussen, RSV-virussen, rhinovirussen en bij coronavirussen zoals SARS-Cov-1, MERS-Cov en de nu heersende SARS-Cov-2.
ROS zijn kort levende moleculen die razendsnel reageren met lichaamseigen stoffen, zoals eiwitten, vetten en genetisch materiaal. Gewoonlijk maakt ons ‘antioxidantensysteem’ deze ROS onschadelijk. Maar niet altijd: in de longen van patiënten die stierven aan influenza, en nog maanden later in werden in het bloed van overlevenden (1) sporen van schade door ROS aangetroffen.
Hoe kan dit? ROS zijn van levensbelang om een indringer uit te schakelen, maar ze zijn dodelijk wanneer hun productie niet kan worden beteugeld. Een aanzienlijk deel van de coronapatiënten lijkt niet te overlijden aan het virus per sé, maar aan een overdreven reactie van hun immuunsysteem, veroorzaakt door deze ROS (1). Dat het virus de doodsoorzaak zou zijn, lijkt bovendien strijdig met de waarneming dat kinderen weliswaar ernstig besmet kunnen zijn met virussen als SAR-Cov-1 (2-4), MERS-Cov (5) en ook SARS-Cov-2 (6,7), maar schijnbaar geen schade van betekenis ondervinden.
Zo’n overdreven immuunreactie kan ook optreden na een hartinfarct (8-10) en fysieke trauma’s, zoals hersenletsel na een ongeluk (11,12). Nieuw is dit inzicht niet. Een niet zo bekende onderzoeker zei eens: ‘Hoofdletsel kan honderdduizenden neuronen vernietigen, maar de secundaire ontstekingsreactie doodt er miljoenen en wellicht zelfs de patiënt.’ Een immuunreactie dient niet alleen gestart, maar ook afgeremd en actief gestopt te worden. Anders ontstaat teveel bijkomende schade. Anders gezegd: de schade die wordt toegebracht aan de indringer moet in balans zijn met de schade die het gevolg is van de ontstekingsreactie van het immuunsysteem.
De balans kan fataal doorslaan als een ‘cytokinenstorm’ opsteekt. Deze begint lokaal maar kan zich uitbreiden door het gehele lichaam (14-24). Cytokinen zijn kleine eiwitten die worden afgegeven door een geactiveerd immuunsysteem, maar ook door virus-geïnfecteerde longcellen. Ze communiceren vele boodschappen naar andere cellen, zoals: ‘kom helpen’, ‘vermenigvuldig je’, ‘start met herstel’, maar ook ‘rem de ontstekingsreactie’. Waarom deze cytokinenstorm wel bij de een optreedt en niet bij de ander is niet bekend. Er is geen afdoende therapie (17,22,23,25). Pogingen om de schade door ROS te beperken met antioxidanten, zoals vitamines A, E en C, selenium, N-acetylcysteïne maar ook kruiden, zijn weinig onderzocht. Bovendien passen ze niet in het denken van westerse artsen die ‘medicijnen’ hebben gestudeerd.
Wat is hier dan wel mogelijk?
Miraculeuze verbeteringen werden bereikt met hooggedoseerde visolie bij hersentrauma (26-31). Dit is te verklaren, doordat uit de visolievetzuren (EPA, DHA) zogenaamde ‘immunoresolvines’ worden gemaakt. Die remmen de immuunreactie op een subtiele en gecontroleerde manier (32-34) af. Of met vitamine D (35-45), selenium (46-50), vitamine C (51-57) of visolie (58-61), of een combinatie daarvan, een cytokinenstorm kan worden gekeerd, is onzeker. Evolutionair niet-toevallig levert voedsel uit de zee cruciale nutriënten voor zowel hersenen (62-67) als immuunsysteem (68).
Zoals altijd is ook hier preventie waarschijnlijk beter. Idealiter verkeert het immuunsysteem in optimale conditie vóór een hartinfarct, (hersen)trauma of infectie; eigenlijk gewoon altijd.
MMV maakt wekelijks een selectie uit het nieuws over voeding en leefstijl in relatie tot kanker en andere medische condities.
Inschrijven nieuwsbrief
Referenties
-
Redox biology
1. Khomich OA, Kochetkov SN, Bartosch B, Ivanov AV. Redox Biology of Respiratory Viral Infections. Viruses. 2018;10(8):392. Published 2018 Jul 26. doi:10.3390/v10080392
https://pubmed.ncbi.nlm.nih.gov/30049972/?from_single_result=Khomich+Viruses+2018#
-
Corona in children
2. Liverpool L. Why don't children seem to get very ill from the coronavirus? HEALTH | ANALYSIS 12 March 2020
-
3. Leung CW, Kwan YW, Ko PW, et al. Severe acute respiratory syndrome among children. Pediatrics. 2004;113(6):e535–e543. doi:10.1542/peds.113.6.e535
https://pubmed.ncbi.nlm.nih.gov/15173534/?from_term=Leung+Pediatrics+2004
-
4. Li AM, Ng PC. Severe acute respiratory syndrome (SARS) in neonates and children. Arch Dis Child Fetal Neonatal Ed. 2005;90(6):F461–F465. doi:10.1136/adc.2005.075309
-
5. Thabet F, Chehab M, Bafaqih H, Al Mohaimeed S. Middle East respiratory syndrome coronavirus in children. Saudi Med J. 2015;36(4):484–486. doi:10.15537/smj.2015.4.10243
https://pubmed.ncbi.nlm.nih.gov/25828287/?from_term=Thabet+Saudi+Med+J+2015&from_pos=1
-
6. Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention [published online ahead of print, 2020 Feb 24]. JAMA.
https://pubmed.ncbi.nlm.nih.gov/32091533/?from_term=Wu+JAMA+2020
-
7. Lu X, Zhang L, Du H, et al. SARS-CoV-2 Infection in Children [published online ahead of print, 2020 Mar 18]. N Engl J Med. 2020;10.1056/NEJMc2005073. doi:10.1056/NEJMc2005073
https://pubmed.ncbi.nlm.nih.gov/32187458/?from_term=Liu+NEJM+2020&from_pos=2
-
Myocardial infarction
8. Nian M, Lee P, Khaper N, Liu P. Inflammatory cytokines and postmyocardial infarction remodeling. Circ Res. 2004;94(12):1543–1553. doi:10.1161/01.RES.0000130526.20854.fa
-
9. Ueland T, Kjekshus J, Frøland SS, et al. Plasma levels of soluble tumor necrosis factor receptor type I during the acute phase following complicated myocardial infarction predicts survival in high-risk patients. J Am Coll Cardiol. 2005;46(11):2018–2021. doi:10.1016/j.jacc.2005.08.039
-
10. Debrunner M, Schuiki E, Minder E, et al. Proinflammatory cytokines in acute myocardial infarction with and without cardiogenic shock. Clin Res Cardiol. 2008;97(5):298–305. doi:10.1007/s00392-007-0626-5
-
Brain trauma
11. Ziebell JM, Morganti-Kossmann MC. Involvement of pro- and anti-inflammatory cytokines and chemokines in the pathophysiology of traumatic brain injury. Neurotherapeutics. 2010;7(1):22–30. doi:10.1016/j.nurt.2009.10.016
-
12. Sordillo PP, Sordillo LA, Helson L. Bifunctional role of pro-inflammatory cytokines after traumatic brain injury. Brain Inj. 2016;30(9):1043–1053. doi:10.3109/02699052.2016.1163618
-
Quote
13. Rogers J. The inflammatory response in Alzheimer's disease. J Periodontol. 2008;79(8 Suppl):1535–1543. doi:10.1902/jop.2008.080171
-
Cytokine storm
14. Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012;76(1):16–32. doi:10.1128/MMBR.05015-11
-
15. Canna SW, Behrens EM. Making sense of the cytokine storm: a conceptual framework for understanding, diagnosing, and treating hemophagocytic syndromes. Pediatr Clin North Am. 2012;59(2):329–344. doi:10.1016/j.pcl.2012.03.002
https://pubmed.ncbi.nlm.nih.gov/22560573/?from_single_result=Canna+Pediatr+Clin+North+Am.+2012
-
16. Teijaro JR, Walsh KB, Rice S, Rosen H, Oldstone MB. Mapping the innate signaling cascade essential for cytokine storm during influenza virus infection. Proc Natl Acad Sci U S A. 2014;111(10):3799–3804. doi:10.1073/pnas.1400593111
-
17. Liu Q, Zhou YH, Yang ZQ. The cytokine storm of severe influenza and development of immunomodulatory therapy. Cell Mol Immunol. 2016;13(1):3–10. doi:10.1038/cmi.2015.74
-
18. Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol. 2017;39(5):529–539. doi:10.1007/s00281-017-0629-x
-
19. Shimabukuro-Vornhagen A, Gödel P, Subklewe M, et al. Cytokine release syndrome. J Immunother Cancer. 2018;6(1):56. Published 2018 Jun 15. doi:10.1186/s40425-018-0343-9
-
20. Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China [published online ahead of print, 2020 Mar 3]. Intensive Care Med. 2020;1–3. doi:10.1007/s00134-020-05991-x
https://pubmed.ncbi.nlm.nih.gov/32125452/?from_single_result=Ruan+Intensive+Care+Med+2020
-
21. Cron R, Chatham W. How doctors can potentially significantly reduce the number of deaths from Covid-19. We already have medicines for treating cytokine storm syndrome, the immune response that’s killing many who die of Covid-19
-
22. Sarzi-Puttini P, Giorgi V, Sirotti S, et al. COVID-19, cytokines and immunosuppression: what can we learn from severe acute respiratory syndrome?. Clin Exp Rheumatol. 2020;38(2):337–342.
https://pubmed.ncbi.nlm.nih.gov/32202240/?from_term=Sarzi-Puttini+Clin+Exp+Rheumatol+2020&from_pos=1
-
23. Pedersen SF, Ho YC. SARS-CoV-2: A Storm is Raging [published online ahead of print, 2020 Mar 27]. J Clin Invest. 2020;137647. doi:10.1172/JCI137647
https://pubmed.ncbi.nlm.nih.gov/32217834/?from_single_result=Pedersen+J+Clin+Invest+2020
-
24. Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China [published online ahead of print, 2020 Mar 3]. Intensive Care Med. 2020;1–3. doi:10.1007/s00134-020-05991-x
Corticosteroids
-
25. Joseph T, Moslehi MA. INTERNATIONAL PULMONOLOGIST’S CONSENSUS ON COVID-19
Fish oil in brain trauma
-
26. Smith S. He's going to be better than he was before'. CNN, January 18, 2014 -- Updated 2109 GMT (0509 HKT).
https://edition.cnn.com/2014/01/18/health/fish-oil-recovery/index.html
-
27. Sears B, Bailes J, Asselin B. Therapeutic uses of high-dose omega-3 fatty acids to treat comatose patients with severe brain injury PharmaNutrition 1(3):86–89. doi.org/10.1016/j.phanu.2013.04.002
-
28. Mills JD, Bailes JE, Sedney CL, Hutchins H, Sears B. Omega-3 fatty acid supplementation and reduction of traumatic axonal injury in a rodent head injury model. J Neurosurg. 2011;114(1):77–84. doi:10.3171/2010.5.JNS08914
https://pubmed.ncbi.nlm.nih.gov/20635852/?from_single_result=Mills+Sears+J+Neurosurg.+2011
-
29. Michael-Titus AT, Priestley JV. Omega-3 fatty acids and traumatic neurological injury: from neuroprotection to neuroplasticity?. Trends Neurosci. 2014;37(1):30–38. doi:10.1016/j.tins.2013.10.005
-
30. Lewis MD. Concussions, Traumatic Brain Injury, and the Innovative Use of Omega-3s. J Am Coll Nutr. 2016;35(5):469–475. doi:10.1080/07315724.2016.1150796
https://pubmed.ncbi.nlm.nih.gov/27454858/?from_term=Lewis+MD&from_sort=date&from_page=5&from_pos=5
-
31. Lewis MD. Use of Omega-3s in Traumatic Brain Injury. Clin Surg. 2017; 2: 1449.
http://www.clinicsinsurgery.com/full-text/cis-v2-id1449.php
Resolvins
-
32. Serhan CN, Chiang N. Endogenous pro-resolving and anti-inflammatory lipid mediators: a new pharmacologic genus. Br J Pharmacol. 2008;153 Suppl 1(Suppl 1):S200–S215. doi:10.1038/sj.bjp.0707489
https://pubmed.ncbi.nlm.nih.gov/17965751/?from_term=Serhan%2C+Br+J+Pharmacol+2008&from_pos=1
-
33. González-Périz A, Clària J. Resolution of adipose tissue inflammation. ScientificWorldJournal. 2010;10:832–856. Published 2010 May 4. doi:10.1100/tsw.2010.77
-
34. Serhan CN, Levy BD. Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators. J Clin Invest. 2018;128(7):2657–2669. doi:10.1172/JCI97943
https://pubmed.ncbi.nlm.nih.gov/29757195/?from_single_result=Serhan+J+Clin+Invest.+2018
Vitamin D
-
35. Cannell JJ, Vieth R, Umhau JC, et al. Epidemic influenza and vitamin D. Epidemiol Infect. 2006;134(6):1129–1140. doi:10.1017/S0950268806007175
-
36. Aloia JF, Li-Ng M. Re: epidemic influenza and vitamin D. Epidemiol Infect. 2007;135(7):1095–1098. doi:10.1017/S0950268807008308
-
37. Moan J, Dahlback A, Ma L, Juzeniene A. Influenza, solar radiation and vitamin D. Dermatoendocrinol. 2009;1(6):307–309. doi:10.4161/derm.1.6.11357
-
38. Ginde AA, Mansbach JM, Camargo CA Jr. Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med. 2009;169(4):384–390. doi:10.1001/archinternmed.2008.560
-
39. Urashima M, Segawa T, Okazaki M, Kurihara M, Wada Y, Ida H. Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren. Am J Clin Nutr. 2010;91(5):1255–1260. doi:10.3945/ajcn.2009.29094
-
40. Hewison M. Antibacterial effects of vitamin D [published correction appears in Nat Rev Endocrinol. 2011 Aug;7(8):436]. Nat Rev Endocrinol. 2011;7(6):337–345. doi:10.1038/nrendo.2010.226
-
41. Iruretagoyena M, Hirigoyen D, Naves R, Burgos PI. Immune Response Modulation by Vitamin D: Role in Systemic Lupus Erythematosus. Front Immunol. 2015;6:513. Published 2015 Oct 12. doi:10.3389/fimmu.2015.00513
-
42. Greiller CL, Martineau AR. Modulation of the immune response to respiratory viruses by vitamin D. Nutrients. 2015;7(6):4240–4270. Published 2015 May 29. doi:10.3390/nu7064240
-
43. Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. Published 2017 Feb 15. doi:10.1136/bmj.i6583
-
44. Rao Muvva J, Parasa VR, Lerm M, Svensson M, Brighenti S. Polarization of Human Monocyte-Derived Cells With Vitamin D Promotes Control of Mycobacterium tuberculosis Infection. Front Immunol. 2020;10:3157. Published 2020 Jan 22. doi:10.3389/fimmu.2019.03157
-
45. Ayelign B, Workneh M, Molla MD, Dessie G. Role Of Vitamin-D Supplementation In TB/HIV Co-Infected Patients. Infect Drug Resist. 2020;13:111–118. Published 2020 Jan 10. doi:10.2147/IDR.S228336
Selenium
-
46. Steinbrenner H, Al-Quraishy S, Dkhil MA, Wunderlich F, Sies H. Dietary selenium in adjuvant therapy of viral and bacterial infections. Adv Nutr. 2015;6(1):73–82. Published 2015 Jan 15. doi:10.3945/an.114.007575
-
48. Mahmoodpoor A, Hamishehkar H, Shadvar K, et al. The Effect of Intravenous Selenium on Oxidative Stress in Critically Ill Patients with Acute Respiratory Distress Syndrome. Immunol Invest. 2019;48(2):147–159. doi:10.1080/08820139.2018.1496098
-
49. Zhao Y, Yang M, Mao Z, et al. The clinical outcomes of selenium supplementation on critically ill patients: A meta-analysis of randomized controlled trials. Medicine (Baltimore). 2019;98(20):e15473. doi:10.1097/MD.0000000000015473
-
50. Zava T. Preventing and Protecting Against Coronavirus – Is Selenium the Answer? The ZRT Laboratory Blog. Tuesday, February 25, 2020
Vitamin C
-
51. Fowler AA 3rd, Truwit JD, Hite RD, et al. Effect of Vitamin C Infusion on Organ Failure and Biomarkers of Inflammation and Vascular Injury in Patients With Sepsis and Severe Acute Respiratory Failure: The CITRIS-ALI Randomized Clinical Trial [published correction appears in JAMA. 2020 Jan 28;323(4):379]. JAMA. 2019;322(13):1261–1270. doi:10.1001/jama.2019.11825
https://pubmed.ncbi.nlm.nih.gov/31573637/?from_term=Fowler+JAMA+2019&from_pos=1
-
52. Fowler AA. Intravenous Vitamin C: Pathway to a New Therapy to Save Lives. 8 november 2018. Video, note the graph at 48:20 minutes.
- 53. Schuitemaker G. Vitamine C bij virusziekten. Intraveneus, of ook oraal? Orthomoleculair Magazine 38e Jaargang nr 1. Februari 2020, blz. 6-11.
-
54. Galt J. Vitamin C (High Doses) CURES Coronavirus / Covid-19 - Dr. Cheng (Preliminary Results) March 19, 2020. Video included.
-
55. Cheng RZ. Can early and high intravenous dose of vitamin C prevent and treat coronavirus disease 2019 (COVID-19). Medicine in Drug Discovery Available online 26 March 2020, 100028. doi.org/10.1016/j.medidd.2020.100028.
https://www.sciencedirect.com/science/article/pii/S2590098620300154?via%3Dihub
-
56. Wald EL, Sanchez-Pinto LN, Smith CM, et al. Hydrocortisone-Ascorbic Acid-Thiamine Use Associated with Lower Mortality in Pediatric Septic Shock [published online ahead of print, 2020 Jan 9]. Am J Respir Crit Care Med. 2020;10.1164/rccm.201908-1543LE. doi:10.1164/rccm.201908-1543LE
https://pubmed.ncbi.nlm.nih.gov/31916841/?from_single_result=Wald+Am+J+Respir+Crit+Care+Med.+2020
-
57. Arabi YM, Fowler R, Hayden FG. Critical care management of adults with community-acquired severe respiratory viral infection. Intensive Care Med. 2020;46(2):315–328. doi:10.1007/s00134-020-05943-5
https://pubmed.ncbi.nlm.nih.gov/32040667/?from_term=Arabi+Fowler+Intensive+Care+Med+2020&from_pos=1
Fish oil
-
58. Hecker M, Linder T, Ott J, et al. Immunomodulation by lipid emulsions in pulmonary inflammation: a randomized controlled trial. Crit Care. 2015;19(1):226. Published 2015 May 12. doi:10.1186/s13054-015-0933-6
https://pubmed.ncbi.nlm.nih.gov/25962383/?from_term=Hecker+Crit+Care.+2015&from_pos=1
-
59. Langlois PL, D'Aragon F, Hardy G, Manzanares W. Omega-3 polyunsaturated fatty acids in critically ill patients with acute respiratory distress syndrome: A systematic review and meta-analysis. Nutrition. 2019;61:84–92. doi:10.1016/j.nut.2018.10.026
-
60. Dushianthan A, Cusack R, Burgess VA, Grocott MP, Calder PC. Immunonutrition for acute respiratory distress syndrome (ARDS) in adults. Cochrane Database Syst Rev. 2019;1(1):CD012041. Published 2019 Jan 24. doi:10.1002/14651858.CD012041.pub2
-
61. Kristine Koekkoek W, Panteleon V, van Zanten AR. Current evidence on ω-3 fatty acids in enteral nutrition in the critically ill: A systematic review and meta-analysis. Nutrition. 2019;59:56–68. doi:10.1016/j.nut.2018.07.013
Brain selective nutrients
-
62. Cunnane SC, Harbige LS, Crawford MA. The importance of energy and nutrient supply in human brain evolution. Nutr Health. 1993;9(3):219–235. doi:10.1177/026010609300900307
-
63. Cunnane SC, Stewart KM. Human brain evolution: the influence of freshwater and marine food resources. New Jersey: Wiley-Blackwell; 2010
-
64. Muskiet FAJ, Kuipers RS. Lessons from shore-based hunter-gatherer diets in East Africa. Chapter 5 in: Cunnane SC, Stewart KM, editors. Human Brain Evolution. 2010; ISBN: 987-0-470-45268-4 ed.: Wiley-Blackwell Hoboken, New Jersey.
-
65. Broadhurst CL, Cunnane SC, Crawford MA. Rift Valley lake fish and shellfish provided brain-specific nutrition for early Homo. Br J Nutr. 1998;79(1):3–21. doi:10.1079/bjn19980004
-
66. Kyriacou K, Blackhurst DM, Parkington JE, Marais AD. Marine and terrestrial foods as a source of brain-selective nutrients for early modern humans in the southwestern Cape, South Africa. J Hum Evol. 2016;97:86–96. doi:10.1016/j.jhevol.2016.04.009
-
67. Cunnane SC. Survival of the Fattest: The Key to Human Brain Evolution. 1st ed. Singapore: World Scientific Publishing Company; 2005.
Immune system selective nutrients
- 68. Maggini S, Pierre A, Calder PC. Immune Function and Micronutrient Requirements Change over the Life Course. Nutrients. 2018;10(10):1531. Published 2018 Oct 17. doi:10.3390/nu10101531https://pubmed.ncbi.nlm.nih.gov/30336639/?from_single_result=Immune+Function+and+Micronutrient+Requirements+Change+over+the+Life+Course_Maggini+Calder+Nutrients+2018








