Transparantie in de klinische onderzoeken naar medicijnen en hulpmiddelen is in Europa ver te zoeken. Nederland is het slechtste jongetje van klas. Hooguit tien procent van de wettelijk verplichte informatie wordt gedeeld. Dat blijkt uit onderzoek door een team uit Oxford en TranspariMED. Sancties blijven vooralsnog uit.
Voor alle duidelijkheid, dit artikel gaat over medicijnonderzoek in mensen. Voor klinisch onderzoek met medische hulpmiddelen zoals borst- en heupimplantaten of stents gelden minder strenge regels.
Sinds 2004 verplicht de Europese Unie farmaceutische ondernemingen, ziekenhuizen en universiteiten hun klinische onderzoeken aan te melden in een speciale database. Het European Clinical Trail Register, EudraCT. Daarin moeten behalve het onderzoeksprotocol, ook de voortgang en de resultaten gerapporteerd worden. De EU laat de controle en eventuele sanctionering over aan de lidstaten. Alleen Denemarken bestraft het niet naleven van de verplichtingen.
Gedreven door Ben Goldacre – arts en schrijver van de boeken ‘Bad Science’ en ‘Bad Pharma’ – werd aan de universiteit van Oxford de laatste jaren relatief veel werk gemaakt van dit onderwerp. Drie jaar geleden publiceerde Goldacre in de British Medical Journal onderzoek naar de rapportageplicht. De conclusie: in minder dan de helft van de onderzoeken werd deze nageleefd.
In het kader van dat onderzoek ontwikkelde de groep een online instrument die de inhoud van EU-database voor het publiek toegankelijk maakt. Deze EU Trials Tracker laat zien welke sponsoren wel en niet aan hun verplichting tegemoet komen. Voor zover gerapporteerd maakt de tracker ook de protocollen en resultaten van individuele trials inzichtelijk.
Zorgwekkend
Het nieuwst onderzoek, nog niet gereviewed gepubliceerd op preprintserver Medrxiv, komt grofweg tot dezelfde conclusies als drie jaar geleden. ‘Er zijn hardnekkige en aanzienlijke gaten in de kwaliteit en de volledigheid van trialdata in de EUCTR.’ De auteurs vinden het ‘zorgwekkend’ dat dit ondanks de duidelijke structuur van de richtlijnen toch het geval is.
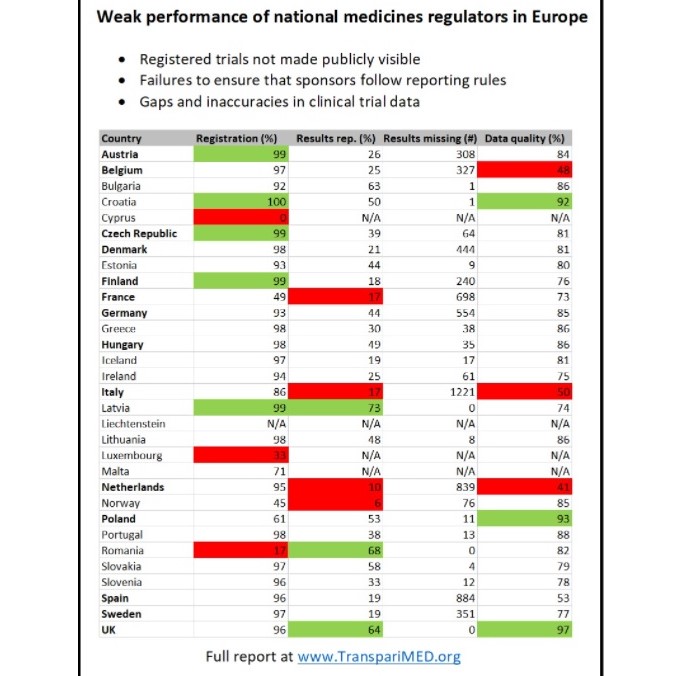
Ditmaal ligt de focus op de verschillen tussen de Europese landen onderling. Nederland wordt in de conclusie apart genoemd als een ‘belangrijk medisch knooppunt’ dat ‘substantiële problemen heeft met datakwaliteit en de beschikbaarheid van resultaten’.
Ranglijst
In samenwerkingen met vier non-gourvermentele organisaties, waaronder Transparency International France en TransperiMED, zetten de auteurs de resultaten per land op een rijtje. ‘Onder de grote regulerende instanties presteert het Nederlandse CCMO (Centrale Commissie Mensgebonden Onderzoek) het slechtst: maar tien procent van de tot 2015 exclusief voor Nederland goedgekeurde trials hebben resultaten beschikbaar in de databank.’ Letland krijgt met 73 procent een eervolle vermelding.
Eerste auteur van de studie Nicholas DeVito zegt: ‘Dit is de eerste omvattende analyse van waar problemen met de datakwaliteit zich voordoen.’ Het Europse register zou een waardevolle bron moeten zijn om klinisch studies die in Europa gedaan worden te begrijpen. ‘Maar we komen vaak niet te weten of een studie plaatsvond, wanneer deze is afgerond en of er resultaten beschikbaar zijn. De functionaliteit van het register is hierdoor ernstig aangetast.’
CCMO: rapportage is verantwoordelijkheid sponsors
Gevraagd naar een reactie, meldt de CCMO in de persoon van voorzitter Joop van Gerven aan MMV dat onderzoek in de eerste plaats openbaar wordt gemaakt in wetenschappelijke tijdschriften en open access platforms. ‘Op die manier worden de zorgprofessionals bereikt die de bevindingen in de praktijk moeten brengen en doorvoeren in behandelrichtlijnen.’ Publicatie in openbare registers is belangrijk, maar: ‘De verantwoordelijkheid daarvoor ligt bij de opdrachtgevers van het onderzoek.’
Bij de CCMO is men zich bewust van het feit dat ‘een aanzienlijk deel van de trials ongepubliceerd blijft’ en ‘betreurt het dat’ herhaalde oproepen tot verbetering ‘niet heeft geleid tot een toename van de publicatie van onderzoeksresultaten in de openbare trialregisters.’ De commissie wijst op het ontbreken van juridische mogelijkheden om publicatie af te dwingen, zegt echter toe ‘zich actiever richting achterblijvende onderzoekers te gaan opstellen om zo de slechte positie die Nederland heeft te verbeteren.’
Voor geneesmiddelenonderzoek – en dus niet het onderzoek naar medische hulpmiddelen – verwacht de CCMO dat de situatie vanaf volgend jaar verandert. Als een Europese verordening van kracht wordt. Registratie van resultaten in het EUCTR zou daarmee ‘een wettelijke verplichting worden, waartegen geen bezwaar mogelijk is’. Lees hier de volledige reactie van de CCMO.
Directeur klinisch onderzoek MSD: EUCTR ‘kans voor open doel’
De verordening heeft meer implicaties dan alleen een mogelijke verbetering van de openbaarmaking van de resultaten. Arjan Ooms, clinical research director bij Merck, Sharpe en Dohme – dochter van Merck & Co, noemt het ‘een kans voor open doel’. In een blog op Skipr schrijft hij: ‘Met het van kracht worden van de European Clinicla Trial Regulation verandert in 2022 de procedure voor het opstarten en indienen van nieuwe studies, met als doel het vereenvoudigen en versnellen van klinisch geneesmiddelenonderzoek.’
Ooms noemt het belang van klinisch onderzoek voor patiënten, artsen en onderzoekers en de Nederlandse economie. ‘De economie krijgt een impuls door investeringen van geneesmiddelenbedrijven. Meer hoogwaardige werkgelegenheid, een aantrekkelijker vestigingsklimaat, meer gezondheid: tel uit je winst als Nederland koploper zou zijn in de Europese eredivisie van het klinisch onderzoek!’
De Nederlandse overheid mag meer stelling nemen, schrijft Ooms. ‘Nu moet het gebeuren. Nu moeten alle betrokkenen – overheid (VWS, CCMO), ziekenhuizen, farmabedrijven en anderen – de handen ineenslaan, zodat Nederland vanaf januari 2022 optimaal profiteert van deze nieuwe wet.’
MMV maakt wekelijks een selectie uit het nieuws over voeding en leefstijl in relatie tot kanker en andere medische condities.
Inschrijven nieuwsbrief