Bij een ketogeen dieet zijn veel voedingsmiddelen taboe en eet je extreem veel vet. Dit heeft een negatief effect op de zuur-base balans in het lichaam en daarmee op diverse organen. Klinisch chemicus Frits Muskiet legt uit waarom een ketogeen dieet zelden een goed idee is.

Het ketogeen dieet is bewezen succesvol bij kinderen die lijden aan een vorm van epilepsie die niet met medicijnen te behandelen is (10-15). Waarschijnlijk komt dat doordat de hersencellen die bij epilepsie betrokken zijn moeite hebben om glucose te benutten (16,17), maar het mechanisme is nog verre van duidelijk. Het dieet wordt eveneens aanbevolen voor gewichtsverlies, verbetering van cognitie en geheugen, behandeling van type 2 diabetes, als adjuvant bij kanker therapie, neurologische aandoeningen (waaronder migraine) en psychiatrische ziektes (40a).
Het ketogeen dieet kent op termijn vele nadelen en die werden reeds lang geleden zichtbaar bij die kinderen. Ze hadden vaker nierstenen (26-30), hun botgroei bleef achter (29,30) en er waren zelfs botfracturen (27-30). Nierstenen kwamen voor bij 5,8 procent van de kinderen en 7,9 procent van de volwassenen. Dat is een meer dan tachtig keer hogere kans op nierstenen dan bij volwassenen die ‘normaal’ eten (31)! In het bloed van elite-atleten werden na 3,5 weken ketogene voeding abnormale gehaltes ‘botmarkers’ gemeten. Dit wijst op een verstoorde bot-opbouw en -afbraak (32).
Ketogeen dieet verstoort zuur-basebalans
Het probleem met het ketogeen dieet zit vooral in het ontstaan van veel zuur. Bij het ketogeen dieet worden ketonlichamen gevormd en die zijn tamelijk zuur. Nieren passen zich hierop aan door een verhoogde uitscheiding van sulfaat, fosfaat, urinezuur, chloride, calcium, magnesium en ammoniumionen. De uitscheiding van citroenzuur vermindert. Veel voedingsmiddelen, zoals vlees, vis, eieren, kaas en zuivelproducten, zijn zuurvormend. Daardoor veroorzaakt het ketogeen dieet een scheve verdeling in de zuur-basebalans, die bekend staat als een ‘lage graad metabole acidose’ (34-41a).
De longen en de nieren bewaken onze zuur-base balans. Overschrijdt de zuurbelasting een grens dan zijn de longen niet meer in staat om zonder te hijgen de zuurbalans te compenseren door meer CO2 (vluchtig zuur) uit te scheiden. Vanaf dat moment gaat het sluipend mis (40). In het bloed zijn geen pH-afwijkingen meetbaar, want die wordt gelukkig uiterst zorgvuldig gereguleerd. Het is alleen af te lezen uit de pH-waarde van de urine, want die wordt zuurder. De nieren maken overuren om een toenemende verzuring van de urine te voorkomen en raken beschadigd door de chronische zuurbelasting.
Het extra zuur reageert met de basen in het lichaam. Onze botten doen dienst als een groot reservoir van base in ons lichaam (42,43). Door reactie met zuur verdwijnt langzaam het botmineraal, terwijl de zure micro-omgeving de botafbraakcellen stimuleert (40).
Korte en lange termijn bijwerkingen
Bij 4 tot 8 procent van de kinderen met epilepsie werd gerapporteerd: slapheid, dehydratie, acidose, gedragsverandering, verhoogd infectiegevaar, obstipatie en overgeven. Deze ontstonden na 2-3 dagen, verdwenen typisch binnen 2 weken en hielden verband met de mate van ketose (40a). Meer dan 30 procent van volwassen gebruikers in online forums rapporteerde last te hebben gehad van de ‘keto-griep’ (Eng: keto flu; ook wel genoemd keto-inductie en keto-adaptatie). De belangrijkste symptomen waren: hoofdpijn, vermoeidheid, misselijkheid, duizeligheid, hersenmist, maagdarmproblemen, verminderde energie, slap gevoel en veranderde hartslag. De symptomen piekten na 1 week, namen in 4 weken geleidelijk af en ze werden door 30 procent als ernstig geduid. Er is nog geen wetenschappelijk onderzoek gedaan naar de oorzaak, maar uitdroging, stoornissen in de elektrolyt huishouding (natrium, kalium, calcium en magnesium), aanpassing van het energiemetabolisme en ‘glucose onthoudingsverschijnselen’ worden op het internet genoemd. Als remedies noemen de forums: verhoogde innames van natrium, magnesium, kalium en water, drinken van een bouillon en gebruik van een elektrolyten supplement (40a-40d).
Gunstig bij kanker?
Bij de behandeling van kanker wordt het ketogeen dieet intensief onderzocht. Een ketogeen dieet vertraagt de groei van bepaalde tumoren en maakt ze gevoeliger voor de reguliere chemo- en radiotherapie (53-64). Waarschijnlijk komt dit doordat de verminderde beschikbaarheid van glucose het Warburgeffect tegenwerkt. Bij het Warburgeffect wordt de glucose grotendeels omgezet in onderdelen voor nieuwe cellen (biomassa) en in mindere mate in energie. Een andere factor is dat de ketose de ontsteking vermindert, maar er zijn meerdere verklaringen (65). Het succes hangt ook samen met het kanker(sub)type, tumoromgeving en genetica (3,65,66). De heersende gedachte is dat kankercellen ketonlichaampjes slechter kunnen benutten. Het blijkt echter dat ketonen de groei en uitzaaiing van kanker ook kunnen bevorderen (64, 67-71).
Conclusie
Voor kinderen met onbehandelbare epilepsie is het (zure) ketogeen dieet een prima therapie, vooral als het gebufferd wordt door de inname van basische supplementen (natriumbicarbonaat en citraat) (26,72).
Een niet-ketogene lage koolhydraat voeding, zoals de MMV voorstaat, mag alle soorten groenten en fruit bevatten en verdient alleen daarom al de voorkeur. Die voeding is gunstig bij de meeste, zo niet alle, aandoeningen. Groente en fruit produceren bicarbonaat (base) en er is beduidend lager risico op tekorten aan vitaminen, mineralen, vezels en fytochemicaliën.
Voor mensen met kanker die vaak al last hebben van ‘verzuring’ (lactaat acidose) lijkt het verstandig om de hoeveelheid zuurvormende voedingsmiddelen te beperken en base-vormende voedingsmiddelen ruim toe te laten.
Het ketogeen dieet wordt op termijn nagenoeg niet volgehouden. Het leidt tot gewichtsverlies (52a), wat gunstig kan zijn, maar bij kanker meestal niet. Om veilig van ketonen te profiteren, kan beter MCT (‘medium chain triglycerides’) olie of een keto-supplement worden genomen (78). MCT-olie dient vooral caprylzuur (een vetzuur met 8 koolstofatomen) te bevatten en komt meestal samen met het veel minder ketogene caprinezuur (10 koolstofatomen). In tegenstelling tot populaire opvattingen en commerciële praatjes is kokosnootolie niet ketogeen (79). Keto-supplementen bestaan uit de ketonen zelf in de vorm van een ‘ester’ (een chemische verbinding tussen een alcohol en een carbonzuur) of als (natrium) zout. MCT-olie en keto-supplementen verhogen de bloedketonen zonder aangepast dieet (78), veroorzaken geen gewichtsverlies en ‘verzuren’ het lichaam niet.
Want één ding is duidelijk: zure urine produceren is voor niemand een goed idee. Een gezonde urine-pH is 6,8-7,0 (40) en niet de 4,6-8,0 die je zelfs op websites van gerenommeerde instituten ziet staan (77).
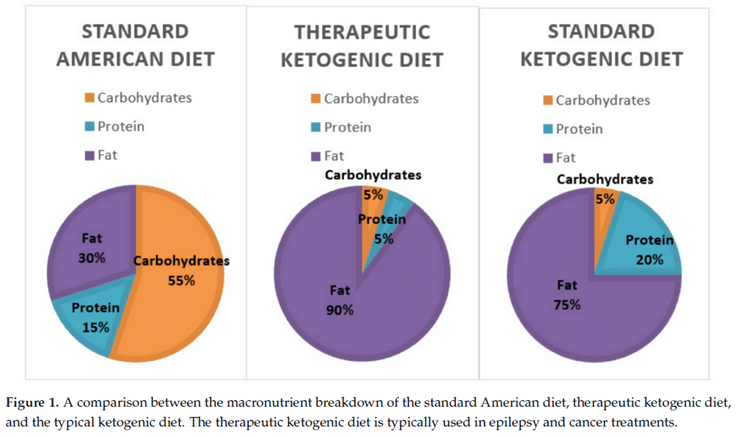
1. Ströhle A, Hahn A. Diets of modern hunter-gatherers vary substantially in their carbohydrate content depending on ecoenvironments: results from an ethnographic analysis. Nutr Res. 2011 Jun;31(6):429-35. doi: 10.1016/j.nutres.2011.05.003. Epub 2011 Jun 12. PMID: 21745624.
https://pubmed.ncbi.nlm.nih.gov/21745624/
2. Crosby L, Davis B, Joshi S, Jardine M, Paul J, Neola M, Barnard ND. Ketogenic Diets and Chronic Disease: Weighing the Benefits Against the Risks. Front Nutr. 2021 Jul 16;8:702802. doi: 10.3389/fnut.2021.702802. PMID: 34336911; PMCID: PMC8322232.
https://pubmed.ncbi.nlm.nih.gov/34336911/
3. Zhu H, Bi D, Zhang Y, Kong C, Du J, Wu X, Wei Q, Qin H. Ketogenic diet for human diseases: the underlying mechanisms and potential for clinical implementations. Signal Transduct Target Ther. 2022 Jan 17;7(1):11. doi: 10.1038/s41392-021-00831-w. PMID: 35034957; PMCID: PMC8761750.
https://pubmed.ncbi.nlm.nih.gov/35034957/
4. Evans M, Cogan KE, Egan B. Metabolism of ketone bodies during exercise and training: physiological basis for exogenous supplementation. J Physiol. 2017 May 1;595(9):2857-2871. doi: 10.1113/JP273185. Epub 2016 Dec 7. PMID: 27861911; PMCID: PMC5407977.
https://pubmed.ncbi.nlm.nih.gov/27861911/
5. Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
https://pubmed.ncbi.nlm.nih.gov/32923239/
6. Grabacka M, Pierzchalska M, Dean M, Reiss K. Regulation of Ketone Body Metabolism and the Role of PPARα. Int J Mol Sci. 2016 Dec 13;17(12):2093. doi: 10.3390/ijms17122093. PMID: 27983603; PMCID: PMC5187893.
https://pubmed.ncbi.nlm.nih.gov/27983603/
7. Lin TY, Liu HW, Hung TM. The Ketogenic Effect of Medium-Chain Triacylglycerides. Front Nutr. 2021 Nov 18;8:747284. doi: 10.3389/fnut.2021.747284. PMID: 34888335; PMCID: PMC8650700.
https://pubmed.ncbi.nlm.nih.gov/34888335/
8. Vandenberghe C, St-Pierre V, Pierotti T, Fortier M, Castellano CA, Cunnane SC. Tricaprylin Alone Increases Plasma Ketone Response More Than Coconut Oil or Other Medium-Chain Triglycerides: An Acute Crossover Study in Healthy Adults. Curr Dev Nutr. 2017 Mar 22;1(4):e000257. doi: 10.3945/cdn.116.000257. PMID: 29955698; PMCID: PMC5998344.
https://pubmed.ncbi.nlm.nih.gov/29955698/
8a. Stubbs BJ, Cox PJ, Evans RD, Santer P, Miller JJ, Faull OK, Magor-Elliott S, Hiyama S, Stirling M, Clarke K. On the Metabolism of Exogenous Ketones in Humans. Front Physiol. 2017 Oct 30;8:848. doi: 10.3389/fphys.2017.00848. PMID: 29163194; PMCID: PMC5670148.
https://pubmed.ncbi.nlm.nih.gov/29163194/
9. Jensen NJ, Wodschow HZ, Nilsson M, Rungby J. Effects of Ketone Bodies on Brain Metabolism and Function in Neurodegenerative Diseases. Int J Mol Sci. 2020 Nov 20;21(22):8767. doi: 10.3390/ijms21228767. PMID: 33233502; PMCID: PMC7699472.
https://pubmed.ncbi.nlm.nih.gov/33233502/
10. Kim DY, Rho JM. The ketogenic diet and epilepsy. Curr Opin Clin Nutr Metab Care. 2008 Mar;11(2):113-20. doi: 10.1097/MCO.0b013e3282f44c06. PMID: 18301085.
https://pubmed.ncbi.nlm.nih.gov/18301085/
11. Liu YM, Wang HS. Medium-chain triglyceride ketogenic diet, an effective treatment for drug-resistant epilepsy and a comparison with other ketogenic diets. Biomed J. 2013 Jan-Feb;36(1):9-15. doi: 10.4103/2319-4170.107154. PMID: 23515148.
https://pubmed.ncbi.nlm.nih.gov/23515148/
12. Nei M, Ngo L, Sirven JI, Sperling MR. Ketogenic diet in adolescents and adults with epilepsy. Seizure. 2014 Jun;23(6):439-42. doi: 10.1016/j.seizure.2014.02.015. Epub 2014 Mar 12. PMID: 24675110.
https://pubmed.ncbi.nlm.nih.gov/24675110/
13. Kossoff EH, Zupec-Kania BA, Auvin S, Ballaban-Gil KR, Christina Bergqvist AG, Blackford R, Buchhalter JR, Caraballo RH, Cross JH, Dahlin MG, Donner EJ, Guzel O, Jehle RS, Klepper J, Kang HC, Lambrechts DA, Liu YMC, Nathan JK, Nordli DR Jr, Pfeifer HH, Rho JM, Scheffer IE, Sharma S, Stafstrom CE, Thiele EA, Turner Z, Vaccarezza MM, van der Louw EJTM, Veggiotti P, Wheless JW, Wirrell EC; Charlie Foundation; Matthew’s Friends; Practice Committee of the Child Neurology Society. Optimal clinical management of children receiving dietary therapies for epilepsy: Updated recommendations of the International Ketogenic Diet Study Group. Epilepsia Open. 2018 May 21;3(2):175-192. doi: 10.1002/epi4.12225. PMID: 29881797; PMCID: PMC5983110.
https://pubmed.ncbi.nlm.nih.gov/29881797/
14. D’Andrea Meira I, Romão TT, Pires do Prado HJ, Krüger LT, Pires MEP, da Conceição PO. Ketogenic Diet and Epilepsy: What We Know So Far. Front Neurosci. 2019 Jan 29;13:5. doi: 10.3389/fnins.2019.00005. PMID: 30760973; PMCID: PMC6361831.
https://pubmed.ncbi.nlm.nih.gov/30760973/
15. Martin-McGill KJ, Bresnahan R, Levy RG, Cooper PN. Ketogenic diets for drug-resistant epilepsy. Cochrane Database Syst Rev. 2020 Jun 24;6(6):CD001903. doi: 10.1002/14651858.CD001903.pub5. PMID: 32588435; PMCID: PMC7387249.
https://pubmed.ncbi.nlm.nih.gov/32588435/
16. Tenney JR, Rozhkov L, Horn P, Miles L, Miles MV. Cerebral glucose hypometabolism is associated with mitochondrial dysfunction in patients with intractable epilepsy and cortical dysplasia. Epilepsia. 2014 Sep;55(9):1415-22. doi: 10.1111/epi.12731. Epub 2014 Jul 22. PMID: 25053176.
https://pubmed.ncbi.nlm.nih.gov/25053176/
17. Govil-Dalela T, Kumar A, Behen ME, Chugani HT, Juhász C. Evolution of lobar abnormalities of cerebral glucose metabolism in 41 children with drug-resistant epilepsy. Epilepsia. 2018 Jul;59(7):1307-1315. doi: 10.1111/epi.14404. Epub 2018 May 22. PMID: 29786852; PMCID: PMC6031462.
https://pubmed.ncbi.nlm.nih.gov/29786852/
18. Croteau E, Castellano CA, Richard MA, Fortier M, Nugent S, Lepage M, Duchesne S, Whittingstall K, Turcotte ÉE, Bocti C, Fülöp T, Cunnane SC. Ketogenic Medium Chain Triglycerides Increase Brain Energy Metabolism in Alzheimer’s Disease. J Alzheimers Dis. 2018;64(2):551-561. doi: 10.3233/JAD-180202. PMID: 29914035.
https://pubmed.ncbi.nlm.nih.gov/29914035/
19. Torosyan N, Sethanandha C, Grill JD, Dilley ML, Lee J, Cummings JL, Ossinalde C, Silverman DH. Changes in regional cerebral blood flow associated with a 45 day course of the ketogenic agent, caprylidene, in patients with mild to moderate Alzheimer’s disease: Results of a randomized, double-blinded, pilot study. Exp Gerontol. 2018 Oct 1;111:118-121. doi: 10.1016/j.exger.2018.07.009. Epub 2018 Jul 10. PMID: 30006299.
https://pubmed.ncbi.nlm.nih.gov/30006299/
20. Phillips MCL, Murtagh DKJ, Gilbertson LJ, Asztely FJS, Lynch CDP. Low-fat versus ketogenic diet in Parkinson’s disease: A pilot randomized controlled trial. Mov Disord. 2018 Aug;33(8):1306-1314. doi: 10.1002/mds.27390. Epub 2018 Aug 11. Erratum in: Mov Disord. 2019 Jan;34(1):157. PMID: 30098269; PMCID: PMC6175383.
https://pubmed.ncbi.nlm.nih.gov/30098269/
21. Fortier M, Castellano CA, Croteau E, Langlois F, Bocti C, St-Pierre V, Vandenberghe C, Bernier M, Roy M, Descoteaux M, Whittingstall K, Lepage M, Turcotte ÉE, Fulop T, Cunnane SC. A ketogenic drink improves brain energy and some measures of cognition in mild cognitive impairment. Alzheimers Dement. 2019 May;15(5):625-634. doi: 10.1016/j.jalz.2018.12.017. Epub 2019 Apr 23. PMID: 31027873.
https://pubmed.ncbi.nlm.nih.gov/31027873/
22. Jensen NJ, Wodschow HZ, Nilsson M, Rungby J. Effects of Ketone Bodies on Brain Metabolism and Function in Neurodegenerative Diseases. Int J Mol Sci. 2020 Nov 20;21(22):8767. doi: 10.3390/ijms21228767. PMID: 33233502; PMCID: PMC7699472.
https://pubmed.ncbi.nlm.nih.gov/33233502/
23. Phillips MCL, Deprez LM, Mortimer GMN, Murtagh DKJ, McCoy S, Mylchreest R, Gilbertson LJ, Clark KM, Simpson PV, McManus EJ, Oh JE, Yadavaraj S, King VM, Pillai A, Romero-Ferrando B, Brinkhuis M, Copeland BM, Samad S, Liao S, Schepel JAC. Randomized crossover trial of a modified ketogenic diet in Alzheimer’s disease. Alzheimers Res Ther. 2021 Feb 23;13(1):51. doi: 10.1186/s13195-021-00783-x. PMID: 33622392; PMCID: PMC7901512.
https://pubmed.ncbi.nlm.nih.gov/33622392/
24. Kovács Z, Brunner B, Ari C. Beneficial Effects of Exogenous Ketogenic Supplements on Aging Processes and Age-Related Neurodegenerative Diseases. Nutrients. 2021 Jun 26;13(7):2197. doi: 10.3390/nu13072197. PMID: 34206738; PMCID: PMC8308443.
https://pubmed.ncbi.nlm.nih.gov/34206738/
25. Pietrzak D, Kasperek K, Rękawek P, Piątkowska-Chmiel I. The Therapeutic Role of Ketogenic Diet in Neurological Disorders. Nutrients. 2022 May 6;14(9):1952. doi: 10.3390/nu14091952. PMID: 35565918; PMCID: PMC9102882.
https://pubmed.ncbi.nlm.nih.gov/35565918/
26. Sampath A, Kossoff EH, Furth SL, Pyzik PL, Vining EP. Kidney stones and the ketogenic diet: risk factors and prevention. J Child Neurol. 2007 Apr;22(4):375-8. doi: 10.1177/0883073807301926. PMID: 17621514.
https://pubmed.ncbi.nlm.nih.gov/17621514/
27. Bergqvist AG. Long-term monitoring of the ketogenic diet: Do’s and Don’ts. Epilepsy Res. 2012 Jul;100(3):261-6. doi: 10.1016/j.eplepsyres.2011.05.020. Epub 2011 Aug 19. PMID: 21855296.
https://pubmed.ncbi.nlm.nih.gov/21855296/
28. Draaisma JMT, Hampsink BM, Janssen M, van Houdt NBM, Linders ETAM, Willemsen MA. The Ketogenic Diet and Its Effect on Bone Mineral Density: A Retrospective Observational Cohort Study. Neuropediatrics. 2019 Dec;50(6):353-358. doi: 10.1055/s-0039-1693059. Epub 2019 Aug 9. PMID: 31398763.
https://pubmed.ncbi.nlm.nih.gov/31398763/
29. Bergqvist AG, Schall JI, Stallings VA, Zemel BS. Progressive bone mineral content loss in children with intractable epilepsy treated with the ketogenic diet. Am J Clin Nutr. 2008 Dec;88(6):1678-84. doi: 10.3945/ajcn.2008.26099. PMID: 19064531.
https://pubmed.ncbi.nlm.nih.gov/19064531/
30. Simm PJ, Bicknell-Royle J, Lawrie J, Nation J, Draffin K, Stewart KG, Cameron FJ, Scheffer IE, Mackay MT. The effect of the ketogenic diet on the developing skeleton. Epilepsy Res. 2017 Oct;136:62-66. doi: 10.1016/j.eplepsyres.2017.07.014. Epub 2017 Jul 26. PMID: 28778055.
https://pubmed.ncbi.nlm.nih.gov/28778055/
30. Ding J, Xu X, Wu X, Huang Z, Kong G, Liu J, Huang Z, Liu Q, Li R, Yang Z, Liu Y, Zhu Q. Bone loss and biomechanical reduction of appendicular and axial bones under ketogenic diet in rats. Exp Ther Med. 2019 Apr;17(4):2503-2510. doi: 10.3892/etm.2019.7241. Epub 2019 Feb 4. PMID: 30906438; PMCID: PMC6425126.
https://pubmed.ncbi.nlm.nih.gov/30906438/
31. Acharya P, Acharya C, Thongprayoon C, Hansrivijit P, Kanduri SR, Kovvuru K, Medaura J, Vaitla P, Garcia Anton DF, Mekraksakit P, Pattharanitima P, Bathini T, Cheungpasitporn W. Incidence and Characteristics of Kidney Stones in Patients on Ketogenic Diet: A Systematic Review and Meta-Analysis. Diseases. 2021 May 25;9(2):39. doi: 10.3390/diseases9020039. PMID: 34070285; PMCID: PMC8161846.
https://pubmed.ncbi.nlm.nih.gov/34070285/
32. Heikura IA, Burke LM, Hawley JA, Ross ML, Garvican-Lewis L, Sharma AP, McKay AKA, Leckey JJ, Welvaert M, McCall L, Ackerman KE. A Short-Term Ketogenic Diet Impairs Markers of Bone Health in Response to Exercise. Front Endocrinol (Lausanne). 2020 Jan 21;10:880. doi: 10.3389/fendo.2019.00880. PMID: 32038477; PMCID: PMC6985427.
https://pubmed.ncbi.nlm.nih.gov/32038477/
34. Frassetto L, Morris RC Jr, Sellmeyer DE, Todd K, Sebastian A. Diet, evolution and aging–the pathophysiologic effects of the post-agricultural inversion of the potassium-to-sodium and base-to-chloride ratios in the human diet. Eur J Nutr. 2001 Oct;40(5):200-13. doi: 10.1007/s394-001-8347-4. PMID: 11842945.
https://pubmed.ncbi.nlm.nih.gov/11842945/
35. Sebastian A, Frassetto LA, Sellmeyer DE, Merriam RL, Morris RC Jr. Estimation of the net acid load of the diet of ancestral preagricultural Homo sapiens and their hominid ancestors. Am J Clin Nutr. 2002 Dec;76(6):1308-16. doi: 10.1093/ajcn/76.6.1308. PMID: 12450898.
https://pubmed.ncbi.nlm.nih.gov/12450898/
36. Adeva MM, Souto G. Diet-induced metabolic acidosis. Clin Nutr. 2011 Aug;30(4):416-21. doi: 10.1016/j.clnu.2011.03.008. Epub 2011 Apr 9. PMID: 21481501.
https://pubmed.ncbi.nlm.nih.gov/21481501/
37. Frassetto L, Kohlstadt I. Treatment and prevention of kidney stones: an update. Am Fam Physician. 2011 Dec 1;84(11):1234-42. PMID: 22150656.
https://pubmed.ncbi.nlm.nih.gov/22150656/
38. Lambert H, Frassetto L, Moore JB, Torgerson D, Gannon R, Burckhardt P, Lanham-New S. The effect of supplementation with alkaline potassium salts on bone metabolism: a meta-analysis. Osteoporos Int. 2015 Apr;26(4):1311-8. doi: 10.1007/s00198-014-3006-9. Epub 2015 Jan 9. PMID: 25572045.
https://pubmed.ncbi.nlm.nih.gov/25572045/
39. Carnauba RA, Baptistella AB, Paschoal V, Hübscher GH. Diet-Induced Low-Grade Metabolic Acidosis and Clinical Outcomes: A Review. Nutrients. 2017 May 25;9(6):538. doi: 10.3390/nu9060538. PMID: 28587067; PMCID: PMC5490517.
https://pubmed.ncbi.nlm.nih.gov/28587067/
40. DiNicolantonio JJ, O’Keefe J. Low-grade metabolic acidosis as a driver of chronic disease: a 21st century public health crisis. Open Heart. 2021 Oct;8(2):e001730. doi: 10.1136/openhrt-2021-001730. PMID: 34702776; PMCID: PMC8549658.
https://pubmed.ncbi.nlm.nih.gov/34702776/
40a. Bostock ECS, Kirkby KC, Taylor BV, Hawrelak JA. Consumer Reports of “Keto Flu” Associated With the Ketogenic Diet. Front Nutr. 2020 Mar 13;7:20. doi: 10.3389/fnut.2020.00020. PMID: 32232045; PMCID: PMC7082414.
https://pubmed.ncbi.nlm.nih.gov/32232045/
40b. Sáenz de Pipaón M, Flores-Rojas K, Gil A, Gil-Campos M. Commentary: Consumer Reports of “Keto Flu” Associated With the Ketogenic Diet. Front Nutr. 2020 Sep 4;7:113. doi: 10.3389/fnut.2020.00113. PMID: 33015113; PMCID: PMC7498532.
https://pubmed.ncbi.nlm.nih.gov/33015113/
40c. Bostock ECS, Kirkby KC, Taylor BV, Hawrelak JA. Response: Commentary: Consumer Reports of “Keto Flu” Associated With the Ketogenic Diet. Front Nutr. 2020 Dec 17;7:575713. doi: 10.3389/fnut.2020.575713. PMID: 33392235; PMCID: PMC7773688.
https://pubmed.ncbi.nlm.nih.gov/33392235/
40d. Cartwright T. WHAT CAUSES KETO FLU? (AND 6 KETO FLU REMEDIES), accessed 21 09 2022
https://drinklmnt.com/blogs/health/what-causes-keto-flu-and-6-keto-flu-remedies
41. DiNicolantonio JJ, O’Keefe JH. Low-grade metabolic acidosis as a driver of insulin resistance. Open Heart. 2021 Sep;8(2):e001788. doi: 10.1136/openhrt-2021-001788. PMID: 34497064; PMCID: PMC8438953.
https://pubmed.ncbi.nlm.nih.gov/34497064/
42. Green J, Kleeman CR. Role of bone in regulation of systemic acid-base balance. Kidney Int. 1991 Jan;39(1):9-26. doi: 10.1038/ki.1991.2. PMID: 1706001.
https://pubmed.ncbi.nlm.nih.gov/1706001/
43. Krieger NS, Frick KK, Bushinsky DA. Mechanism of acid-induced bone resorption. Curr Opin Nephrol Hypertens. 2004 Jul;13(4):423-36. doi: 10.1097/01.mnh.0000133975.32559.6b. PMID: 15199293.
https://pubmed.ncbi.nlm.nih.gov/15199293/
44. Goraya N, Wesson DE. Management of the Metabolic Acidosis of Chronic Kidney Disease. Adv Chronic Kidney Dis. 2017 Sep;24(5):298-304. doi: 10.1053/j.ackd.2017.06.006. PMID: 29031356.
https://pubmed.ncbi.nlm.nih.gov/29031356/
45. Goraya N, Wesson DE. Kidney Response to the Spectrum of Diet-Induced Acid Stress. Nutrients. 2018 May 11;10(5):596. doi: 10.3390/nu10050596. PMID: 29751620; PMCID: PMC5986476.
https://pubmed.ncbi.nlm.nih.gov/29751620/
46. Goraya N, Simoni J, Sager LN, Pruszynski J, Wesson DE. Acid retention in chronic kidney disease is inversely related to GFR. Am J Physiol Renal Physiol. 2018 May 1;314(5):F985-F991. doi: 10.1152/ajprenal.00463.2017. Epub 2018 Jan 3. PMID: 29357423.
https://pubmed.ncbi.nlm.nih.gov/29357423/
47. Goraya N, Wesson DE. Clinical evidence that treatment of metabolic acidosis slows the progression of chronic kidney disease. Curr Opin Nephrol Hypertens. 2019 May;28(3):267-277. doi: 10.1097/MNH.0000000000000491. PMID: 30681417; PMCID: PMC6467553.
https://pubmed.ncbi.nlm.nih.gov/30681417/
48. Goraya N, Simoni J, Sager LN, Madias NE, Wesson DE. Urine citrate excretion as a marker of acid retention in patients with chronic kidney disease without overt metabolic acidosis. Kidney Int. 2019 May;95(5):1190-1196. doi: 10.1016/j.kint.2018.11.033. Epub 2019 Mar 1. PMID: 30846270.
https://pubmed.ncbi.nlm.nih.gov/30846270/
49. Goraya N, Wesson DE. Novel dietary and pharmacologic approaches for acid-base modulation to preserve kidney function and manage uremia. Curr Opin Nephrol Hypertens. 2020 Jan;29(1):39-48. doi: 10.1097/MNH.0000000000000568. PMID: 31725012.
https://pubmed.ncbi.nlm.nih.gov/31725012/
50. Goraya N, Munoz-Maldonado Y, Simoni J, Wesson DE. Treatment of Chronic Kidney Disease-Related Metabolic Acidosis With Fruits and Vegetables Compared to NaHCO3 Yields More and Better Overall Health Outcomes and at Comparable Five-Year Cost. J Ren Nutr. 2021 May;31(3):239-247. doi: 10.1053/j.jrn.2020.08.001. Epub 2020 Sep 18. PMID: 32952009.
https://pubmed.ncbi.nlm.nih.gov/32952009/
51. Saitsu A, Iwazu Y, Matsushita H, Hayashi H, Mizuhashi Y, Kotani K. Low urine pH associated with sarcopenia in the elderly: A multi-center observational study. Medicine (Baltimore). 2021 May 28;100(21):e26114. doi: 10.1097/MD.0000000000026114. PMID: 34032755; PMCID: PMC81544
https://pubmed.ncbi.nlm.nih.gov/34032755/
52. Yang SW, Lin YJ, Cheng YW, Chen YY, Chen WL. Low urine pH is a risk factor for low muscle mass: A new way to predict sarcopenia. Geriatr Gerontol Int. 2021 Oct;21(10):944-949. doi: 10.1111/ggi.14269. Epub 2021 Aug 28. PMID: 34453776.
https://pubmed.ncbi.nlm.nih.gov/34453776/
52a. Włodarek D. Role of Ketogenic Diets in Neurodegenerative Diseases (Alzheimer’s Disease and Parkinson’s Disease). Nutrients. 2019 Jan 15;11(1):169. doi: 10.3390/nu11010169. PMID: 30650523; PMCID: PMC6356942.
https://pubmed.ncbi.nlm.nih.gov/30650523/
53. Allen BG, Bhatia SK, Anderson CM, Eichenberger-Gilmore JM, Sibenaller ZA, Mapuskar KA, Schoenfeld JD, Buatti JM, Spitz DR, Fath MA. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014;2:963-70. doi: 10.1016/j.redox.2014.08.002. Epub 2014 Aug 7. PMID: 25460731; PMCID: PMC4215472.
https://pubmed.ncbi.nlm.nih.gov/25460731/
54. Bozzetti F, Zupec-Kania B. Toward a cancer-specific diet. Clin Nutr. 2016 Oct;35(5):1188-95. doi: 10.1016/j.clnu.2015.01.013. Epub 2015 Jan 23. PMID: 25707910.
https://pubmed.ncbi.nlm.nih.gov/25707910/
55. Winter SF, Loebel F, Dietrich J. Role of ketogenic metabolic therapy in malignant glioma: A systematic review. Crit Rev Oncol Hematol. 2017 Apr;112:41-58. doi: 10.1016/j.critrevonc.2017.02.016. Epub 2017 Feb 20. PMID: 28325264.
https://pubmed.ncbi.nlm.nih.gov/28325264/
56. Weber DD, Aminzadeh-Gohari S, Tulipan J, Catalano L, Feichtinger RG, Kofler B. Ketogenic diet in the treatment of cancer – Where do we stand? Mol Metab. 2020 Mar;33:102-121. doi: 10.1016/j.molmet.2019.06.026. Epub 2019 Jul 27. PMID: 31399389; PMCID: PMC7056920.
https://pubmed.ncbi.nlm.nih.gov/31399389/
57. Poff A, Koutnik AP, Egan KM, Sahebjam S, D’Agostino D, Kumar NB. Targeting the Warburg effect for cancer treatment: Ketogenic diets for management of glioma. Semin Cancer Biol. 2019 Jun;56:135-148. doi: 10.1016/j.semcancer.2017.12.011. Epub 2017 Dec 30. PMID: 29294371; PMCID: PMC6927557.
https://pubmed.ncbi.nlm.nih.gov/29294371/
58. Hagihara K, Kajimoto K, Osaga S, Nagai N, Shimosegawa E, Nakata H, Saito H, Nakano M, Takeuchi M, Kanki H, Kagitani-Shimono K, Kijima T. Promising Effect of a New Ketogenic Diet Regimen in Patients with Advanced Cancer. Nutrients. 2020 May 19;12(5):1473. doi: 10.3390/nu12051473. PMID: 32438645; PMCID: PMC7284721.
https://pubmed.ncbi.nlm.nih.gov/32438645/
59. Li J, Zhang H, Dai Z. Cancer Treatment With the Ketogenic Diet: A Systematic Review and Meta-analysis of Animal Studies. Front Nutr. 2021 Jun 9;8:594408. doi: 10.3389/fnut.2021.594408. PMID: 34179051; PMCID: PMC8219874.
https://pubmed.ncbi.nlm.nih.gov/34179051/
60. Talib WH, Mahmod AI, Kamal A, Rashid HM, Alashqar AMD, Khater S, Jamal D, Waly M. Ketogenic Diet in Cancer Prevention and Therapy: Molecular Targets and Therapeutic Opportunities. Curr Issues Mol Biol. 2021 Jul 3;43(2):558-589. doi: 10.3390/cimb43020042. PMID: 34287243; PMCID: PMC8928964.
https://pubmed.ncbi.nlm.nih.gov/34287243/
61. Lan Y, Jin C, Kumar P, Yu X, Lenahan C, Sheng J. Ketogenic Diets and Hepatocellular Carcinoma. Front Oncol. 2022 May 4;12:879205. doi: 10.3389/fonc.2022.879205. PMID: 35600387; PMCID: PMC9115558.
https://pubmed.ncbi.nlm.nih.gov/35600387/
62. Dmitrieva-Posocco O, Wong AC, Lundgren P, Golos AM, Descamps HC, Dohnalová L, Cramer Z, Tian Y, Yueh B, Eskiocak O, Egervari G, Lan Y, Liu J, Fan J, Kim J, Madhu B, Schneider KM, Khoziainova S, Andreeva N, Wang Q, Li N, Furth EE, Bailis W, Kelsen JR, Hamilton KE, Kaestner KH, Berger SL, Epstein JA, Jain R, Li M, Beyaz S, Lengner CJ, Katona BW, Grivennikov SI, Thaiss CA, Levy M. β-Hydroxybutyrate suppresses colorectal cancer. Nature. 2022 May;605(7908):160-165. doi: 10.1038/s41586-022-04649-6. Epub 2022 Apr 27. PMID: 35477756.
https://pubmed.ncbi.nlm.nih.gov/35477756/
63. Yang L, TeSlaa T, Ng S, Nofal M, Wang L, Lan T, Zeng X, Cowan A, McBride M, Lu W, Davidson S, Liang G, Oh TG, Downes M, Evans R, Von Hoff D, Guo JY, Han H, Rabinowitz JD. Ketogenic diet and chemotherapy combine to disrupt pancreatic cancer metabolism and growth. Med (N Y). 2022 Feb 11;3(2):119-136. doi: 10.1016/j.medj.2021.12.008. PMID: 35425930; PMCID: PMC9004683.
https://pubmed.ncbi.nlm.nih.gov/35425930/
64. Barrea L, Caprio M, Tuccinardi D, Moriconi E, Di Renzo L, Muscogiuri G, Colao A, Savastano S; Obesity Programs of nutrition, Education, Research and Assessment (OPERA) group. Could ketogenic diet “starve” cancer? Emerging evidence. Crit Rev Food Sci Nutr. 2022;62(7):1800-1821. doi: 10.1080/10408398.2020.1847030. Epub 2020 Dec 4. PMID: 33274644.
https://pubmed.ncbi.nlm.nih.gov/33274644/
65. Tran Q, Lee H, Kim C, Kong G, Gong N, Kwon SH, Park J, Kim SH, Park J. Revisiting the Warburg Effect: Diet-Based Strategies for Cancer Prevention. Biomed Res Int. 2020 Aug 4;2020:8105735. doi: 10.1155/2020/8105735. PMID: 32802877; PMCID: PMC7426758.
https://pubmed.ncbi.nlm.nih.gov/32802877/
66. Elisia I, Krystal G. The Pros and Cons of Low Carbohydrate and Ketogenic Diets in the Prevention and Treatment of Cancer. Front Nutr. 2021 Feb 25;8:634845. doi: 10.3389/fnut.2021.634845. PMID: 33718419; PMCID: PMC7946860.
https://pubmed.ncbi.nlm.nih.gov/33718419/
67. Authier S, Tremblay S, Dumulon V, Dubuc C, Ouellet R, Lecomte R, Cunnane SC, Bénard F. [11C] acetoacetate utilization by breast and prostate tumors: a PET and biodistribution study in mice. Mol Imaging Biol. 2008 Jul-Aug;10(4):217-23. doi: 10.1007/s11307-008-0143-6. Epub 2008 May 3. PMID: 18454299.
https://pubmed.ncbi.nlm.nih.gov/18454299/
68. Bonuccelli G, Tsirigos A, Whitaker-Menezes D, Pavlides S, Pestell RG, Chiavarina B, Frank PG, Flomenberg N, Howell A, Martinez-Outschoorn UE, Sotgia F, Lisanti MP. Ketones and lactate “fuel” tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism. Cell Cycle. 2010 Sep 1;9(17):3506-14. doi: 10.4161/cc.9.17.12731. Epub 2010 Sep 21. PMID: 20818174; PMCID: PMC3047616.
https://pubmed.ncbi.nlm.nih.gov/20818174/
69. Martinez-Outschoorn UE, Prisco M, Ertel A, Tsirigos A, Lin Z, Pavlides S, Wang C, Flomenberg N, Knudsen ES, Howell A, Pestell RG, Sotgia F, Lisanti MP. Ketones and lactate increase cancer cell “stemness,” driving recurrence, metastasis and poor clinical outcome in breast cancer: achieving personalized medicine via Metabolo-Genomics. Cell Cycle. 2011 Apr 15;10(8):1271-86. doi: 10.4161/cc.10.8.15330. PMID: 21512313; PMCID: PMC3117136.
https://pubmed.ncbi.nlm.nih.gov/21512313/
70. Martinez-Outschoorn UE, Lin Z, Whitaker-Menezes D, Howell A, Lisanti MP, Sotgia F. Ketone bodies and two-compartment tumor metabolism: stromal ketone production fuels mitochondrial biogenesis in epithelial cancer cells. Cell Cycle. 2012 Nov 1;11(21):3956-63. doi: 10.4161/cc.22136. Epub 2012 Sep 19. PMID: 23082721; PMCID: PMC3507491.
https://pubmed.ncbi.nlm.nih.gov/23082721/
71. Liang L, Li W, Li X, Jin X, Liao Q, Li Y, Zhou Y. ‘Reverse Warburg effect’ of cancer‑associated fibroblasts (Review). Int J Oncol. 2022 Jun;60(6):67. doi: 10.3892/ijo.2022.5357. Epub 2022 Apr 15. PMID: 35425996.
https://pubmed.ncbi.nlm.nih.gov/35425996/
72. McNally MA, Pyzik PL, Rubenstein JE, Hamdy RF, Kossoff EH. Empiric use of potassium citrate reduces kidney-stone incidence with the ketogenic diet. Pediatrics. 2009 Aug;124(2):e300-4. doi: 10.1542/peds.2009-0217. Epub 2009 Jul 13. PMID: 19596731; PMCID: PMC5590010.
https://pubmed.ncbi.nlm.nih.gov/19596731/
73. O’Neill B, Raggi P. The ketogenic diet: Pros and cons. Atherosclerosis. 2020 Jan;292:119-126. doi: 10.1016/j.atherosclerosis.2019.11.021. Epub 2019 Nov 28. PMID: 31805451.
https://pubmed.ncbi.nlm.nih.gov/31805451/
74. Rafiullah M, Musambil M, David SK. Effect of a very low-carbohydrate ketogenic diet vs recommended diets in patients with type 2 diabetes: a meta-analysis. Nutr Rev. 2022 Feb 10;80(3):488-502. doi: 10.1093/nutrit/nuab040. PMID: 34338787.
https://pubmed.ncbi.nlm.nih.gov/34338787/
75. Johnston CS, Tjonn SL, Swan PD, White A, Hutchins H, Sears B. Ketogenic low-carbohydrate diets have no metabolic advantage over nonketogenic low-carbohydrate diets. Am J Clin Nutr. 2006 May;83(5):1055-61. doi: 10.1093/ajcn/83.5.1055. PMID: 16685046.
https://pubmed.ncbi.nlm.nih.gov/16685046/
76. Bueno NB, de Melo IS, de Oliveira SL, da Rocha Ataide T. Very-low-carbohydrate ketogenic diet v. low-fat diet for long-term weight loss: a meta-analysis of randomised controlled trials. Br J Nutr. 2013 Oct;110(7):1178-87. doi: 10.1017/S0007114513000548. Epub 2013 May 7. PMID: 23651522.
https://pubmed.ncbi.nlm.nih.gov/23651522/
77. Urine pH test. Mount Sinai. Accessed 18 06 2022
78. Lilamand M, Mouton-Liger F, Di Valentin E, Sànchez Ortiz M, Paquet C. Efficacy and Safety of Ketone Supplementation or Ketogenic Diets for Alzheimer’s Disease: A Mini Review. Front Nutr. 2022 Jan 17;8:807970. doi: 10.3389/fnut.2021.807970. PMID: 35111799; PMCID: PMC8803132.
https://pubmed.ncbi.nlm.nih.gov/35111799/
79. Vandenberghe C, St-Pierre V, Pierotti T, Fortier M, Castellano CA, Cunnane SC. Tricaprylin Alone Increases Plasma Ketone Response More Than Coconut Oil or Other Medium-Chain Triglycerides: An Acute Crossover Study in Healthy Adults. Curr Dev Nutr. 2017 Mar 22;1(4):e000257. doi: 10.3945/cdn.116.000257. PMID: 29955698; PMCID: PMC5998344.
MMV maakt wekelijks een selectie uit het nieuws over voeding en leefstijl in relatie tot kanker en andere medische condities.
Inschrijven nieuwsbrief








